FDA医药产品CGMP警告信分析
 |
 |
 |
| 第1页 |
参见附件(399KB,4页)。
摘要:统计分析FDA发布的医药产品CGMP相关警告信,推测FDA对医药产品质量管理体系监管的重点和意图,为我国医药企业提高质量管理水平提供借鉴。
关键词:医药产品;CGMP;警告信
中图分类号:F763文献标识码:C文章编号:1672-979X(2007)11-0070-04
Analysis on FDA's CGMP Warning Letters of Medical Products
LIU Jing, LIU Yu-jun, LIANG Yi*
(International Business School, China Pharmaceutical University, Nanjing 210009, China)
Abstract:Based on the statistical analysis on the CGMP Warning Letters of medical products issued by FDA, FDA's administrative emphasis and intent on quality management system of medical products are presumed in order to improve the level of quality management of medical businesses in China.
Key words:medical products; CGMP; warning letters
美国食品药品监督管理局(FDA)警告信是给予违反美国《食品、药品和化妆品法案》的企业或个人的第一官方告知书[1]。FDA检查官员对医药产品生产企业质量保证体系进行现场检查,并以483表的形式要求企业解释检查中出现的问题。若得不到满意的解释,即发出警告信,意味着FDA将拒绝此企业产品进入美国市场,并且建议不批准所有使用此企业产品生产的新药申请。
1资料分析
1.1获取并筛选资料
本研究选取FDA官方网站警告信数据库中2002年1月1日~2006年12月31日对非美国本土企业发布的所有警告信,共2904封。(1)按数据库提供的主题摘要筛选出与医药产品相关的警告信(医药产品种类包括药用活性成分、制剂产品、生物制品、血液制品、医院制剂、医疗器械等;用途包括人用和兽用),筛选关键词:active pharmaceutical ingredient(s),finished pharmaceutical(s), biological product(s),pharmacy compounding,blood,device(s);(2)从所有的警告信中按主题筛选出与CGMP相关的警告信。筛选关键词:GMP,CGMP,current good manufacturing,good manufacturing,QSR,quality system regulation。
从上述2个筛选结果的合集中,结合警告信具体内容,除去销售、标签、食品等非相关主题,得到FDA给予非美国本土企业的医药产品CGMP相关警告信(以下简称相关警告信)共658封。
1.2统计数据
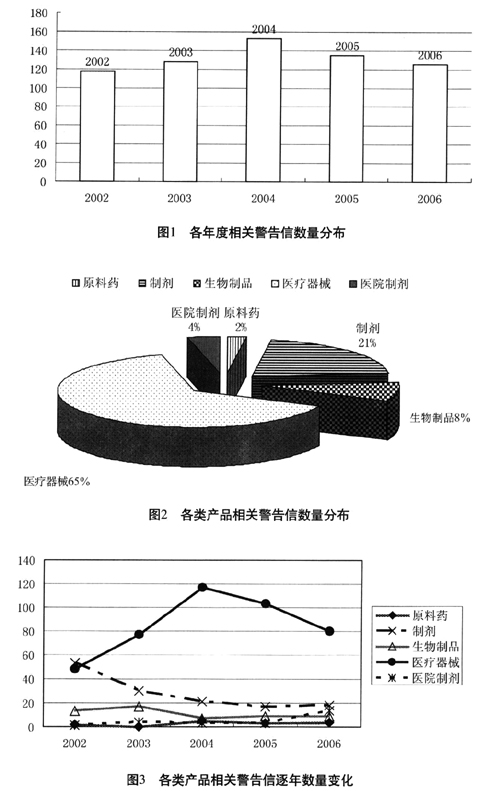
1.2.1 按发布年份统计FDA 2002~2006年相关警告信数量分布如图1。
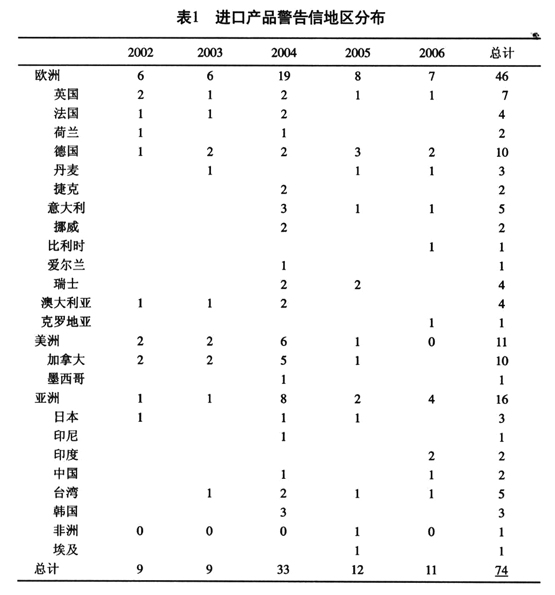
1.2.2 按产品分类统计按涉及的产品将相关警告信分为原料药、制剂、生物制品、医疗器械、医院制剂5类。其中,原料药指药用活性成分(active pharmaceutical ingredient);制剂指化学药品的制剂(drug product,finished pharmaceutical);生物制品包括血液及血制品(blood,blood product and blood components);医院制剂指医院及药房针对个体患者临时配制的药品(pharmacy compounding)。统计结果见图2。
2讨论
2.1警告信的构成
由图1可见,2002~2006年相关警告信的年发布量较恒定,在117~153封之间,平均每年131封。FDA在其管理的药品、食品、化妆品三大类产品中,对医药类产品的关注程度随时间变化不大。
由图2可见,各类医药产品的警告信数量差别较大。其中医疗器械产品的警告信数量最多(425封),占总发布量的65%;其次是制剂产品(139封),占总量的21%;再次是生物制品(55封),占总量的8%;最后是医院制剂和原料药(25封和14封),分别占总量的4%和2%。
2.2对各类产品的监控状态
如果将警告信的发布作为企业质量出现波动的信号,那么图3可在一定程度上反映各类产品生产企业的质量管理水平,并可推测FDA对各类医药产品的监控重点和意图。
原料药和生物制品的警告信在各年总量中所占比例均较小,且各年数量分布平均,较少出现波动。推测进入美国市场的原料药和生物制品生产企业质量管理水平较为成熟;制剂产品的警告信数量逐年下降,表明制剂产品生产企业质量保证水平日趋提高;医疗器械产品的警告信数量相当庞大,推测此类产品是目前FDA的监控重点。美国市场中此类产品的生产企业质量管理水平差别较大。医疗器械产品小到棉签、注射器等,大到超声诊断仪、心脏起搏器等,种类繁多,生产工艺差别极大。监管复杂,监控难度大也是其警告信数量较大的原因之一;医院制剂的警告信数量呈逐渐增加趋势。特别是2006年,此类产品的警告信数量猛增,当年警告信数量较前一年增加了近400%。可见,FDA正在逐渐加大对医院制剂产品CGMP符合性的监管力度。
2.3非美国本土企业的质量管理状态
由表1可看出,2002~2006年间,收到相关警告信的美国本土外企业主要集中在欧洲,其数量占FDA发往国外所有警告信总量的56.8%,亚洲企业收到警告信相应比例为21.6%,美洲(主要是加拿大)为14 ......
您现在查看是摘要介绍页,详见PDF附件(399KB,4页)。