中国制药企业原料药出口的国际认证(1)
 |
[摘要]本文具体详实地描述了中国制药企业原料药出口欧洲和美国等发达市场时药品注册所应具备的基本条件,明确地描述了药物原料药注册时申请FDA认证。欧盟EDMF申请/COS证书认证所需要的文件、文件的格式以及认证的详细程序等,并且对未来全球范围内在ICH指南的前提下统一和规范药品注册所使用的CTD格式文件作了明确的说明,目的在于使中国原料药出口企业对于国际认证的现状和未来有所了解,明确认识国际注册认证程序和所需要的文件,生产工厂所应具备的基本条件等,并能对加快我国原料药的出口起到一定的促进作用。
[关键词]原料药;药物注册;FDA认证;DMF;EDMF;COS认证
[中图分类号]TQ460.4 [文献标识码]C [文章编号]1673-7210(2011)08(b)-111-04
众所周知,在过去的10年里越来越多的中国生产厂家都在寻求各种各样的出口机会,同时也面临了越来越多的国外政府机构或者制剂企业严格的质量审计,中国的制药企业也借此机会不断提高了自身的质量管理体系,安全管理体系以及整体企业形象。
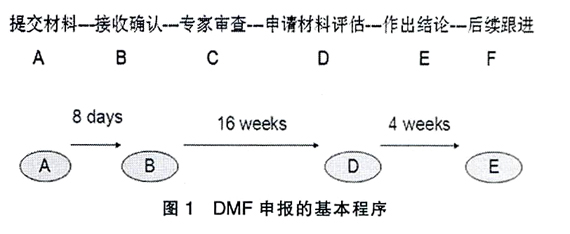
原料药企业产品出口面向的主要地区为美国和欧盟国家。理所当然原料药出口企业必须通过上述国家和地区质量,生产体系的审计(GMP),并完成产品注册。产品注册涉及到美国食品及药物管理局(Food and Drug Admistraton ......
您现在查看是摘要页,全文长 5126 字符。