肠粘连大鼠血TGF-β1的变化
 |
【摘 要】 目的 观察大鼠肠粘连模型血转化生长因子-β1(transforming growth factor β1,TCF-β1)变化。方法 选取 60只SD雄性大鼠随机分为两组:正常对照组(n=30)、观察组(n=30)。除正常对照组外,观察组大鼠按 E1lis法制备成肠粘连模型。各组于术后第2、5、9 d取血,酶联免疫吸附法测定TGF-β1水平。结果 TGF-β1在大鼠肠粘连模型中术后2 d明显升高,与对照组相比有显著性差异(P<0.01);术后5 d时TGF-β1升至峰值,与术后2 d时相比有显著性差异(P<0.01);术后9 d时TGF-β1下降,与术后2、5 d相比,均有显著性差异(P<0.05~0.01)。结论 TGF-β1是影响肠粘连形成的细胞因子。
【关键词】 肠粘连;转化生长因子-β1;酶联免疫吸附
, 百拇医药
腹部手术后腹腔粘连是一种常见的临床现象,可导致严重的并发症,如肠梗阻、腹腔和盆腔疼痛、不孕和不育等。近年来对腹腔粘连的研究较多,有的已进到分子水平。本实验从细胞因子水平进一步探讨术后肠粘连的机制。
1 材料与方法
1.1 实验动物 SD雄性大鼠,体质量200~250 g。由中国药品生物制品检定所实验动物中心提供。随机取30只作为对照组,其余30只作为观察组。
1.2 试剂及仪器 戊巴比妥钠(中国医药上海化学试剂公司,批号 F20020405);TGF-β1试剂盒〔晶美(深圳)生物工程公司,美国 R&D 公司,批号212344〕;-86℃超低温冰箱(美国 Forma Scientific公司);550型酶联免疫检测仪(美国 Bio-Rad公司)。
1.3 试验方法
, 百拇医药
1.3.1 大鼠实验性肠粘连模型的制备[1] 观察组所有动物禁食不禁水12 h,以2%戊巴比妥钠溶液(30 mg/kg)腹腔注射麻醉。麻醉后将大鼠仰卧固定于手术板上,腹部脱毛,常规消毒,铺无菌巾,取下腹部正中切口约2 cm,提出盲肠,置于无菌纱布上约5 min,使浆膜干燥,以解剖刀片轻刮整个盲肠浆膜10遍,造成轻度渗血,再加1滴无水乙醇于创面上,然后以无齿镊夹住盲肠系膜动脉约2 min,造成暂时局部缺血。盲肠回纳入腹腔原位后以止血钳夹伤相应腹壁分2层以1~0号丝线缝合关闭腹腔。
1.3.2 检测的指标与方法 观察组分别于造模后第 2、5、9天采血,每个时相点各取10只动物,用2%戊巴比妥钠溶液(30 mg/kg)腹腔注射麻醉,腹部取“U”形切口开腹,用无菌纱布拨开腹腔脏器,暴露腹主动脉,头皮针穿刺采血至普通生化管,室温静置,2 h内以4 000 r/min离心20 min,分离血清,留取血清存于超低温冰箱待测。严格按试剂盒说明书操作,采用 ELISA法测各样本A值,绘制标准曲线,并换算TGF-β1含量。对照组术后处理同观察组。
, 百拇医药
1.4 统计学处理 数据采用 SPSS 10.0统计分析。计量资料结果用均数±标准差(x±s)表示,进行单因素多个样本均数比较的方差分析,显著性水准为a=0.05。
2 结果
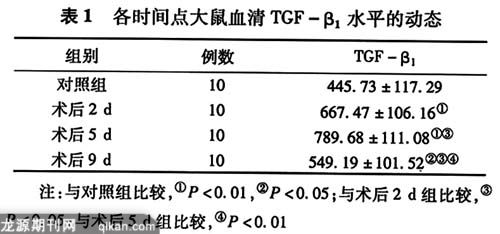
造模后2、5 d时观察组中TGF-β1含量较对照组有显著增加(P<0.01);造模后9d时观察组中TGF-β1含量降低(P<0.01)。结果提示TGF-β1值从组织损伤至肠粘连形成过程中经历了一个由异常升高到逐渐下降的过程,峰值在术后5 d(见表1)。
3 讨论
3.1 TGF-β是一类调节细胞生长与分化的多功能细胞因子,主要来源于血小板、巨噬细胞、成纤维细胞、人胚胎,单核细胞、中性粒细胞、巨噬细胞等。TGF-β能趋化成纤维细胞和炎症细胞,促进细胞增值、分化。它还是细胞外基质许多成分表达、合成、沉积和转换的主要调节剂。哺乳动物中TGF-β1有三种类型,即TGF-β1、TGF-β2、TGF-β3,不同的器官表达不同的TGF-β,表达量与粘连形成有关[2],腹腔器官、浆膜组织及粘连部位表达TGF-β1、TGF-β3增多,其中TGF-β1在组织损伤中效应最强。
, 百拇医药
3.2 在腹膜损伤后愈合过程中,TGF-β的作用尤为重要。如果TGF-β的活力过度,将会引起纤维性变和粘连形成。在腹膜粘连过程中,TGF-b可能在损伤、炎性反应及纤维化之间起桥梁作用:腹膜损伤后血小板和巨噬细胞释放TGF-β,启动一个连锁反应,破坏了纤维蛋白溶解与合成的平衡,同时还导致细胞外基质的沉积,从而促进了腹膜粘连的形成。Chegini[4]发现在无损伤的腹膜中TGF-β1~3免疫反应强度非常低,但在腹壁损伤后纤维粘连形成部位的各类细胞中,TGF-β及其受体的表达水平均显著升高。在大鼠损伤子宫模型中,腹腔内局部使用TGF-β后粘连形成率及粘连程度明显高于对照组[5]。近年来有报道,在大鼠腹腔内使用TGF-β抗体可显著降低粘连发生率和粘连程度[6]。
3.3 目前认为在众多与肠粘连有关的细胞因子中,TGF-β起着关键性的作用[7]。有实验报道[3],TGF-β1可抑制组织型纤溶酶原激活剂(t-PA)的活性,增强组织型纤溶酶原抑制剂活性,导致大量的基质纤维胶状物不能被分解而永久性沉积下来,形成粘连。本实验采用ELISA法定量检测血TGF-β1的含量,具有较高的准确性和灵敏度。研究发现,在造模后第2天,TGF-β1含量明显高于正常组织,提示TGF-β1在腹膜粘连的形成中确有一定影响作用。术后第5 d时TGF-β1含量升至峰值。术后9 d时TGF-β1降低,说明TGF-β1主要在粘连形成的早期发挥作用。术后第 2、5、9天3个时间点TGF-β1差异有统计学意义(P<0.05~0.01),故提示TGF-β1与粘连的形成有密切联系。因此我们推测,TGF-β1是影响腹膜粘连形成的重要细胞因子之一。这为我们探讨预防肠粘连提供了更可靠的依据和方法。
, 百拇医药
参考文献
1 李会晨,王梦炎,侯连兵,等.常通口服液对大鼠术后肠粘连的预防作用.第一军医大学学报,1999,19(5):466.
2 Chegini N,Kotseos K,Zhao Y,Bennett B,Mclean FW,Diamond MP,Holmdahl L,Burns J.Differential expression of TGF-beta1 and TGF-beta3 in serosal tissues of human intraperitoneal organs and peritoneal adhesions.Hum Reprod,2001,16:1291-1300.
3 chegini N,Gold LI,Williams RS,et al.Localization of transforming growth factor beta isoforms TGF-betal,TGF-beta 2,and TGF-beta3 in surgicaUy induced pelvic adhesions in the rat.Obstet Gynecol,1994,83:449.
, http://www.100md.com
4 Woessmer JF Jr.The family of matrix metal-loproteinases.In:Greenwald RA,Go lub LM.Inhibition of ma trix metal loproteinases:therapeutic potelltial.Ann NY Acad Sci,1994,732:11.
5 Lucas PA,Werejeka DJ,Young HE,et al.Formation of abdominal adhesion is inhibited by antibodies to transforming growth factor-β.J Surg Res,1996,15:135.
6 Chegini N.The role ofgrowth factors in peritoneal healing:transforming growth factor beta(TGF-beta).Eur J Surg,1997,577(Suppl):17.
7 Falk P,Ma C,Chegini N,et al.Differential regulation of mesothelial cell fibrinolysis by transforming growth factor beta 1.Scand J Clin Lab Invest,2000,60:439-447., 百拇医药(李 娜 林 宏 郭新华)