细胞因子在软骨细胞分化形成中的影响和作用
 |
 |
 |
摘 要目的:研究和评价转化生长因子-β1(TGF-β1)和胰岛素样生长因子-Ⅰ(IGF-Ⅰ)在BMG三维支架中对骨髓基质干细胞(SMCs)向软骨细胞分化的影响和作用。方法:分离骨髓基质干细胞,将无血清Mc5A培养液分为A'B'C'D 四组,先进行单层细胞培养,再置于松质骨基质明胶(BMG)支架中继续培养,然后进行甲苯胺蓝染色、蛋白多糖含量的测定。结果:各组单层细胞培养的细胞个数均有显著性差异,即A组﹥B组﹥C组﹥D组;第20天后各组的BMG支架蛋白多糖含量,即A组﹥C组﹥B组﹥D组(p﹤0.05)。结论:TGF-β1可提高骨髓基质干细胞的软骨分化能力,而IGF-Ⅰ可提高TGF-β1对骨髓基质干细胞软骨分化作用。
关键词骨髓基质干细胞;软骨细胞分化;细胞因子;(TGF-β1、IGF)
骨髓基质干细胞(mesenchymal stem cells, MSCs)在特定条件下可诱导分化为软骨细胞,人体内骨髓中MSCs的含量极其稀少,因此体外纯化和扩增MSCs就显得尤为重要。这些干细胞经过培养传代扩增,向软骨细胞方向分化,最终形成软骨[1]。已证实一些细胞因子如成纤维细胞生长因子(bFGF)、转化生长因子(TGF-β1)、胰岛素样生长因子(IGF-Ⅰ)可以动员MSCs向软骨细胞分化[2],我们同时应用TGF-β1和IGF-Ⅰ与MSCs结合进行培养,观察其对MSCs软骨分化作用,并与单纯应用TGF-β1和IGF-Ⅰ时对MSCs诱导分化的结果向比较。在自制的BMG支架中培养兔的骨髓SMCs,研究和评价TGF-β1+IGF-Ⅰ、TGF-β1、IGF-Ⅰ对骨髓SMCs向软骨细胞诱导分化的影响和作用。
, http://www.100md.com
1材料和方法
1.1BMG的制备
在无菌条件下,切取2月龄新西兰大白兔髂骨,去筋膜及皮质骨,剩下的松质骨,用5mmol/L NaN3洗去血液,并浸泡24小时。用1:1氯仿甲醇反复脱脂直至液体清亮后,风浴挥发。1.0mmol/l 盐酸进行脱钙48小时,再次脱脂过夜,风浴挥发。依次用2mol/L CaCI2、0.5mol/L EDTA溶液浸泡、4mol/L LiCI连续抽提24小时,用三蒸水反复漂洗除去残余试剂。以无水乙醇无水乙醚脱水、制成松质骨基质明胶(BMG)呈海绵状,-20℃保存,使用前紫外线照射12小时灭菌。
1.2 MSCs分离
取健康2月龄大白兔2~2.5千克(华中科技大学同济医学院实验动物中心)雌雄不限。氯胺酮+异丙嗪肌注麻醉,双侧髂部剪毛后碘伏消毒,在无菌条件下用16号骨穿刺针在髂骨翼外侧穿入骨髓腔,针管内含有0.1ml肝素钠生理盐水,抽吸骨髓液6ml移入Mc5A培养液5ml的离心管内混匀,1500 r/min离心5分钟,弃上层脂肪和上清。加入适量无血清培养液悬浮细胞,缓慢移入盛有比重为1.077淋巴细胞分离液的离心管中,以2000 r/min离心20分钟,小心吸取界面的有核细胞乳白层,加入Mc5A培养液10ml,制成细胞悬液移入25cm2培养瓶中,置于37℃、5%CO2及饱和湿度培养箱中培养,倒置显微镜下观察呈形态一致的均质的分布均匀的细胞,计数每瓶中含有1.5×105个细胞/ml时,收集的骨髓MSC低温存储。
, 百拇医药
1.3培养和诱导MSC
将无血清Mc5A培养液分为A’B’C’D’ 四组:以每瓶中含有1.5×105个细胞/ml开始诱导培养,在24孔培养板中培养,分为四组,每组10个孔,孔内加入含有5 n g/ml TGF-β1和100ng/ml IGF-Ⅰ无血清Mc5A培养液作为A组,加入含有5 n g/ml TGF-β1无血清Mc5A培养液为B组,加入含有100ng/ml IGF-Ⅰ无血清Mc5A培养液作为C组,不加任何试剂的无血清Mc5A培养液作为D组作为空白对照组。第5天时进行细胞传代,并计数细胞个数。第10天细胞长满了瓶壁,在进行细胞传代,即用0.25%胰蛋白酶清洗贴壁的细胞,将未贴壁的死细胞及分泌代谢产物清洗倒出,再往瓶内加入0.25%胰蛋白酶3-5ml,放入培养箱中2-3分钟,观察瓶内贴壁的细胞已分离成为悬浮的圆形细胞,轻轻倒出胰酶,加入5ml上述的四种不同的无血清Mc5A培养液。在无菌条件下将约7×7mm2大小的块状BMG支架置入每个孔内,使悬浮的细胞液覆盖于支架上,第20天时观察BMG支架中细胞形态及分布,收集BMG支架低温储存。
, 百拇医药
1.4统计学分析
实验所得的数据以X±S表示,行方差分析,统计学处理。
2实验结果
2.1细胞形态和生长情况
最初接种的骨髓细胞悬液中呈圆形、大小不一,24h后,沉淀于瓶底,部分较大的圆形单核细胞贴壁;48h后贴壁的单核细胞开始增多,部分变成椭圆形;72h后细胞出现纺垂形改变,A组和B组的贴壁细胞明显增多;第5天时换液,在换液过程中骨髓中的造血干细胞不会贴壁而逐渐清除掉,细胞逐渐形成分散的细胞集落,其形状与大小各不相同,多为成纤维样细胞形态(图1)。第8天以后C组含有IGF-Ⅰ的培养瓶中有核细胞增殖加快,细胞数量明显增加。D组培养瓶中有核细胞数量相对较少。第10天时各培养瓶中集落细胞不断扩增,形态多转化为长梭形,少数呈多角形、三角形,分布不均(图2);观察细胞在BMG支架上爬满了细胞,呈团状或漩涡状生长,大量细胞长入松质骨海绵网孔内,且贴壁生长分布均匀(图3)。
, 百拇医药
* 代表与空白对照组相比具有显著性差,MSC细胞个数均值和误差用X±S表示(p<0.05)。
统计学分析:第5天时A组与B、C、D组均有显著性差异,而B组与C组相比较亦有显著性差异;第10天时A、B、C组与空白对照组相比较均有显著性差异,A组与B、C组相比较亦有显著性差异,B组与C组相比较无显著性差异(p<0.05)。
2.2组织学检查
在所有组织切片中进行甲苯胺兰染色,显示细胞周围基质异染呈阳性,说明均含有蛋白多糖,其中A组异染性较强,B 组和C组次之,D组较差(图省落 )。
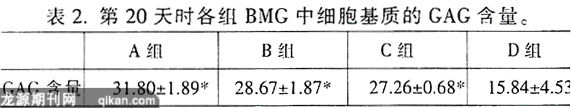
2.3GAG含量测定
第20天时通过二甲基亚甲基蓝比色法测定各组标本的GAG含量,天然关节软骨GAG含量为(50.46±7.50)mg/g。见表2。
, 百拇医药
*代表具有显著性差异,A组与各组相比较有显著性差异,B、C组与D组相比较有显著性差异(P<0.05)
3讨论
3.1本试验鉴于BMG具有良好的组织相容性,呈三维立体结构,可塑性强,且含有生物活性物质,对软骨细胞有支持和诱导的双重作用,因此BMG支架有可能成为一种较理想的软骨细胞支架。Urist等[3]认为BMG植入软骨缺损中后,其所含的BMP与间充质细胞膜表面受体结合,使细胞膜表面电荷发生改变,DNA序列发生改变,激活基因调节因子,诱导出能产生软骨和骨的DNA合成。Reddi等[4]研究认为BMG引起局部蛋白溶解,释放趋化因子,使间充质细胞趋附,通过纤维粘连蛋白(Fibronectin)及相关的细胞粘附蛋白与基质粘附,BMG释放有丝分裂因子促进细胞生长,在BMP的作用下,使间充质细胞分化为软骨细胞和骨细胞。我们自制的BMG经过脱钙、去脂、去蛋白等处理,降低了抗原性,保留了诱导软骨分化的活性因子,并且具有良好的组织亲和性和结合力。细胞三维培养有利于维持其形状,保持软骨细胞的表型和刺激基质代谢合成。我们利用自制的BMG作为载体,分析不同诱导剂对骨髓基质细胞软骨化作用,在各组中均观察到随时间的变化细胞数量不断增殖,可以看出BMG支架具有良好的生物相容性,支持和促进细胞的分化和生长。BMG提供了软骨细胞的良好环境,使MSCs在孔隙中粘附、分化和生长,它既可作为成软骨的支架,又可成为诱导软骨分化的TGF-β1和IGF-Ⅰ的载体,使生物活性因子在支架微环境中维持必要的浓度和持续释放,以发挥诱导软骨分化的功效。, 百拇医药(孙 辉 刘俊宾)