上海市小容量注射剂过滤和灭菌工艺条件的调研及如何确保产品安全性的探讨(1)
 |
 |
中图分类号:R953文献标识码:A文章编号:1006-1533(2007)08-0355-06
2006年“齐二药”、“欣弗”事件接连发生,注射剂产品的安全性问题引起了全社会的高度关注。作为药品生产企业和药品监管部门,如何找出影响注射剂安全性的一些关键因素,从药品生产工艺的研发和药品注册审评的源头就严把产品安全关,是值得我们共同思考的问题。
本文以对上海市最终灭菌的小容量注射剂灭菌和除菌工艺的调查结果为切入点,尝试进行分析和思考,以期引起有关药品生产企业和药品监管部门的重视,使注射剂的安全性得到进一步的保证。
1调查结果
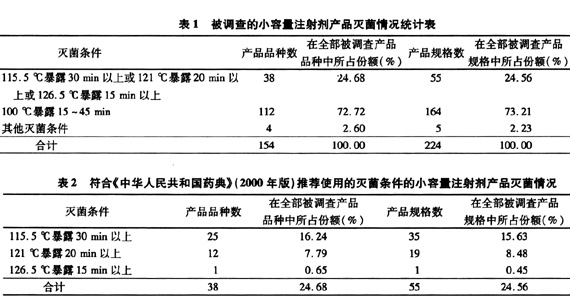
对最终灭菌的小容量注射剂而言,产品的无菌是一个不言而喻的、非常重要的安全性指标。通常在最终灭菌的小容量注射剂的生产过程中,可使产品达到无菌的工艺方法有除菌过滤和湿热灭菌。然而,在对小容量注射剂生产企业的检查过程中,笔者发现不少过滤和湿热灭菌的工艺过程不能足以确保产品的无菌,企业对于如何确保灭菌的有效性认识不足,缺乏必要的管理措施。此外,原国家药品监管部门批准的部分小容量注射剂产品的过滤和灭菌工艺亦有值得商榷之处。
为此,上海市食品药品监督管理局认证审评中心GMP部曾于2003年对上海市生产湿热灭菌小容量注射剂的14家药品生产企业进行了专项调查。该次调查的药品生产企业既有国有企业,也有外资企业,调查的品种既有化学药品,也有中药制剂,制备工艺中包括过滤和湿热灭菌,但除菌过滤后不经湿热灭菌的品种不在该次调查范围内 ......
您现在查看是摘要页,全文长 5848 字符。