药物一致性评价实施与药用辅料关联审评的探讨(3)
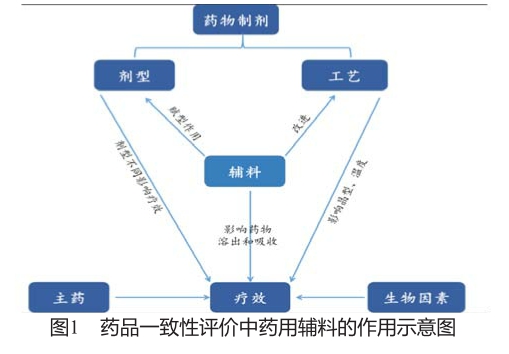 |
同时CFDA明确药品注册申请人所在地食品药品监督管理部门应加强延伸监管,将药用辅料生产企业纳入正常监管范围,药用辅料和包材与药品的关联审评政策尘埃落定。辅料供应商和药品生产企业将不再仅仅是卖方和买方的供应链关系,而需要建立更为紧密的战略合作伙伴关系。由于药品质量最终责任在药品生产企业,药品生产企业尤其需要慎重选择合作伙伴。除了在研发阶段的技术和样品的大力支持,合作伙伴是否可以按时保质保量提供所需要的资料,合作伙伴长期的供应能力(避免各种原因的停产断货导致的麻烦)以及产品质量长期保证能力等都需要制药企业进行仔细评估。辅料的审评直接与制剂品种有关,辅料生产企业要随时接受下游制剂企业的审计和监管机构的日常监管,这对辅料技术和标准的提升是很大的促进。
4 药用辅料行业的机遇与挑战[3]
4.1 关联审评的推行对药用辅料行业的影响
4.1.1 市场环境更加规范,行业规模有望快速扩大
参考欧美发达国家的药用辅料市场在整个药品市场的占比,加上关联审评新政实施,促进了行业规范化,也提高了行业内部对药用辅料的重视。预计辅料占国内制剂行业的比值将快速提升,行业市场规模将快速扩大,整个药用辅料市场达到千亿的时代将很快到来。
4.1.2 药用辅料市场重新分配,大型企业将迎来新的一轮扩张
就制剂企业来说,新政下为避免生产停滞的风险以及规避因辅料不合格而造成的转换成本,会优先选择正规化的辅料企业。就药用辅料企业自身来说,公告中要求国产药用辅料在2018年1月1日前按照新的申报资料向食品药品监督管理部门提交资料 ......
您现在查看是摘要页,全文长 5834 字符。